除菌過濾工藝及系統設計
標簽: 折疊濾芯
過濾工藝的設計
1、除菌過濾
藥品生產企業在選擇除菌過濾器供應商時,應審核供應商提供的驗證文件和質量證書,確保選擇的過濾器是除菌級過濾器。藥品生產企業應將除菌過濾器廠家作為供應商進行管理,例如進行文件審計或工廠現場審計、質量協議和產品變更控制協議的簽訂等。
- 過濾工藝設計時,應根據待過濾介質屬性及工藝目的,選擇合適的過濾器并確定過程參數:對于除菌過濾來說,什么是合適的過濾器呢?法規要求:除菌過濾工藝應根據工藝目的,選用0.22微米(更小孔徑或相同過濾效力)的除菌級過濾器。0.1微米的除菌級過濾器通常用于支原體的去除。
- 對無菌藥品生產的全過程進行微生物控制,避免微生物污染。最終除菌過濾前,待過濾介質的微生物污染水平一般小于等于10cfu/100ml:這條明確了過濾前,待過濾介質的微生物水平,如果達不到這個要求,需要先通過預過濾降低微生物負荷,才能進行除菌過濾。
2、過濾工藝設計需考慮的點
| 過濾器材質 | 選擇過濾器材質時,應充分考察其與待過濾介質的兼容性。過濾器不得因與產品發生反應、釋放物質或吸附作用而對產品質量產生不利影響。除菌過濾器不得脫落纖維,嚴禁使用含有石棉的過濾器。 | 過濾膜的化學兼容性是指其在接觸液體時可能發生的變形、溶解、析出或強度改變等情況。在過濾典型的水溶液時,這種情況較少發生。但在極端pH或有機溶劑存在的情況下,可能發生類似的情況。 |
| 過濾面積 | 合理的過濾膜面積需要經過科學的方法評估后得出。面積過大可能導致產品收率下降、過濾成本上升;過濾面積過小可能導致過濾時間延長、中途堵塞甚至產品報廢。 | 通常情況下,在選擇合適的過濾裝置前需要進行Vmax小試實驗以確定過濾膜面積。但進行某些非堵塞性水樣液體的過濾(如某些大輸液和緩沖液)時,可簡單采用供應商提供的壓力流速曲線進行過濾面積和過濾裝置的選擇。設置一定的安全系數以保證過濾過程順利進行。 |
| 過濾系統結構 | 應注意過濾系統結構的合理性,避免存在衛生死角。過濾器進出口存在一定的限流作用。應根據工藝需要,選擇合適的進出口大小。 | 不同過濾器接口內徑大小不同,在一定流速下的壓差也會有較大差異。另外,過濾方向不同的過濾器壓差也會有差異。 |
| 過濾器參數 | 選擇過濾器時,應根據實際工藝要求,確定過濾溫度范圍、最長過濾時間、過濾流速、滅菌條件、進出口壓差范圍或過濾流速范圍等工藝參數,并確認這些參數是否在可承受范圍內。 | 這條規定了除菌過濾工藝必須明確過濾工藝的相關參數,這些參數的確定需要進行工藝驗證,詳情可見上期《除菌過濾技術及應用指南》要點解讀之除菌過濾驗證 |
過濾系統的設計
1、序列過濾
通常通過兩個或以上相同或遞減孔徑的過濾方式,統稱為序列過濾:由預過濾器和除菌過濾器(在這里也可以成為終端過濾器)組成。這種組合多用于可最終滅菌產品。預過濾器可以使用大孔徑的膜濾芯或PP濾芯)另一種序列過濾系統是指在過濾工藝中經過驗證需要一系列(兩個或以上)的除菌級過濾器才能達到除菌效果的系統,那么這一系列的過濾器被認為是一個除菌單元,在使用后必須全部通過完整性測試。過濾器使用后,除菌過濾器必須全部通過完整性測試。
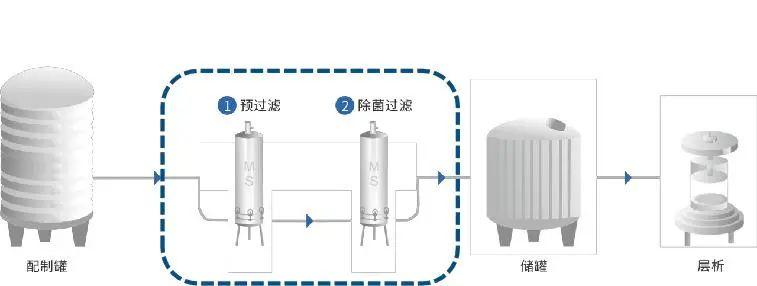
2、冗余過濾
序列過濾系統中,如果在最終除菌過濾器前增加一個除菌級過濾器,并且確保兩個過濾器之間無菌,以及控制過濾前介質的微生物污染水平一般小于等于10cfu/100ml,這種情況下稱為冗余過濾系統。冗余過濾系統中,接近灌裝點的過濾器稱為主過濾器,其前端的過濾器則稱為冗余過濾器。由兩級除菌級過濾器串聯組成。多用于非最終滅菌產品。兩級除菌級過濾器都是經過驗證的,每級濾芯都可以單獨起到除菌過濾的效果。
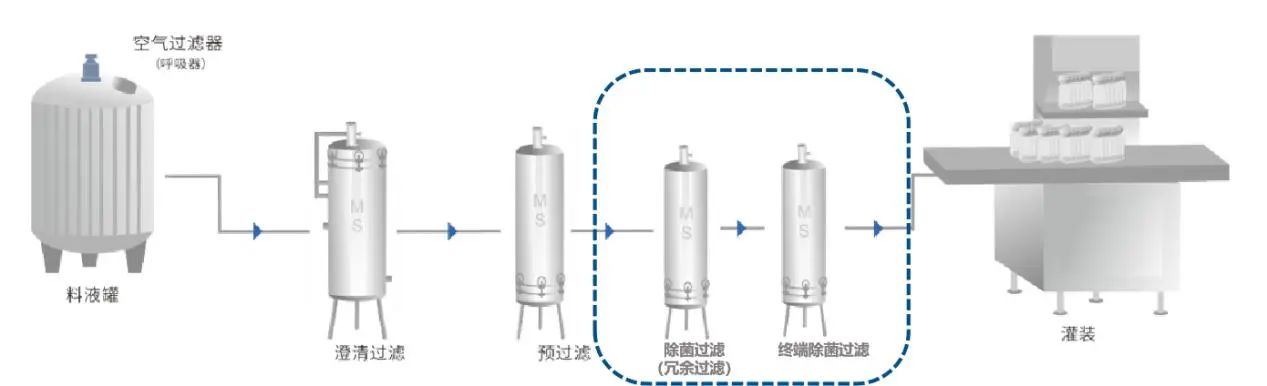
3、過濾系統設計需考慮的點
- 過濾器位置設計時應該考慮有菌氣體或液體的釋放,并且根據產品批量、管路長短、安裝和滅菌方便性等,確認過濾器安裝的區域和位置。(解讀:為了防止在高風險區域釋放有菌氣體或液體,除菌過濾器系統中的首級濾器應盡可能安置在無菌區域外。而第二級過濾器可根據產品批量大小、管路長短、滅菌和安裝方便性等,安置在C級,或B級,或A級區。)
- 應考慮過濾器完整性測試的方便性及其給系統帶來的微生物污染風險。過濾器滅菌后,接觸其下游系統的氣體和沖洗液體必須是無菌的。
- 應充分考慮系統滅菌的安全性和方便性。使用在線滅菌方式時,應考慮系統內冷空氣及冷凝水的排放問題,從而保證系統溫度最低點也能達到預期的F0值。采用離線方法滅菌時,應充分考慮轉移和安裝過程的風險。
4、一次性過濾系統設計需考慮的點
- 需進行使用前完整性測試或預沖洗
- 上游連接管路的耐壓性、下游的無菌性、下游能提供足夠的空間進行排氣排水
- 如果使用一次性無菌連接裝置,應有文件證明不會有微生物進入污染的風險
5、注意事項
- 在設計除菌過濾系統時,應充分認識除菌過濾工藝的局限性。由于除菌過濾器不能將病毒或支原體全部濾除,可采用熱處理等方法來彌補除菌過濾的不足。(解讀:在設計除菌過濾系統時,應充分認識除菌過濾工藝的局限性,比如不能將病毒和支原體全部濾除)
- 冗余過濾系統使用后,如果主過濾器完整性測試通過,則冗余過濾器不需要進行完整性測試;如果主過濾器完整性測試失敗,冗余過濾器必須通過完整性測試。(解讀:過濾器使用后,只需對后端的濾芯進行完整性測試。只有在后端濾芯完整性測試失敗的情況下才需要對前端濾芯進行完整性測試。其目的是為了避免濾芯完整性失敗導致的整批次藥品損失。)
序列過濾VS冗余過濾
以下情況,除菌過濾工藝被認為是冗余過濾:
- 兩個過濾器都是除菌級過濾器
- 兩個過濾器之間的流體流道是無菌的
- 到達第一級過濾器前的料液生物負荷小于10cfu/100ml
- 兩個過濾器應可以分別進行完整性測試
冗余過濾器是法規必須要求嗎?
- CFDA要求:盡可能采取措施降低過濾除菌的風險,例如宜安裝第二只已滅菌的除菌過濾器,最終的除菌過濾濾器應當盡可能接近灌裝點。
- FDA要求:Use of redundant sterilizing filters should be considered in many cases.
- 歐盟要求:A second filtration via a further sterilised micro-organism retaining filter, immediately prior to filling, may be advisable.
由上可見,冗余過濾是一種降低風險的設計方式,是法規建議而并不是要求。企業應根據風險評估確定是否需要冗余過濾,建議加入冗余過濾。從現狀來看,在新車間設計時,冗余過濾已成為標配。
參考文獻:
[1]《藥品生產質量管理規范》(2010年修訂)及附錄
[2] PDA Technical Report No.40, Sterilizing Filtration of Gases.
[3] PDA Technical Report No.26 Revised 2008, Sterilizing Filtration of Liquids.
[4] USFDA Guidance for Industry, Sterile Drug Products Produced by Aseptic Processing-Current Good Manufacturing Practice, 2004.
[5] EU Guidelines to Good Manufacturing Practice, Annex 1 Manufacture of Sterile Medicinal Products, 2008.
[6] http://www.dr-techgz.com.cn/Article-100717.html
[7] 國家藥品監督管理局《除菌過濾技術及應用指南》(2018.10)












.jpg)